- In:
- Posted By: Capuano Edoardo
- Commenti: 0
La tecnologia CRISPR e la ricerca genetica hanno dato nuove speranze per i pazienti, sebbene la loro sicurezza sia ancora fonte di notevole preoccupazione.
La cura di malattie genetiche debilitanti è una delle grandi sfide della medicina moderna. Durante l'ultimo decennio, lo sviluppo delle tecnologie CRISPR e i progressi nella ricerca genetica hanno portato nuove speranze per i pazienti e le loro famiglie, sebbene la sicurezza di questi nuovi metodi sia ancora fonte di notevole preoccupazione.
Un team di biologi dell'University of California San Diego, che include la borsista post-dottorato Sitara Roy, la specialista Annabel Guichard (1) e il professor Ethan Bier (2) descrive un nuovo approccio più sicuro che potrebbe correggere i difetti genetici in futuro. La loro strategia, che fa uso di macchinari naturali per la riparazione del DNA, fornisce una base per nuove strategie di terapia genica con il potenziale per curare un ampio spettro di malattie genetiche. Questa ricerca è stata pubblicata da Science Advances. (3)
In molti casi, coloro che soffrono di malattie genetiche portano mutazioni distinte nelle due copie dei geni ereditati dai genitori. Ciò significa che spesso una mutazione su un cromosoma avrà una controparte di sequenza funzionale sull'altro cromosoma. I ricercatori hanno utilizzato gli strumenti di editing genetico CRISPR per sfruttare questo fatto.
«La variante sana può essere utilizzata dal macchinario di riparazione della cellula per correggere la mutazione difettosa dopo aver tagliato il DNA mutante», ha affermato Guichard, l'autore senior dello studio, «Sorprendentemente, questo può essere ottenuto in modo ancora più efficiente da un semplice innocuo nick».
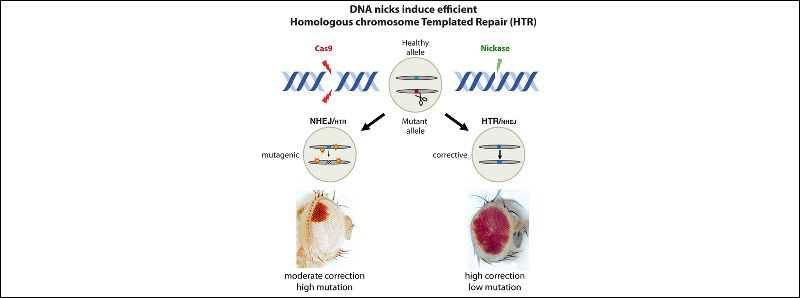
Lavorando sui moscerini della frutta, i ricercatori hanno progettato mutanti che consentono la visualizzazione di tale “riparazione del modello cromosomico omologa” o HTR, mediante la produzione di pigmenti nei loro occhi. Tali mutanti inizialmente presentavano occhi completamente bianchi. Ma quando le stesse mosche esprimevano i componenti CRISPR (un RNA guida più Cas9), mostravano grandi macchie rosse sugli occhi, segno che il meccanismo di riparazione del DNA della cellula era riuscito a invertire la mutazione usando il DNA funzionale dell'altro cromosoma.
Hanno quindi testato il loro nuovo sistema con varianti Cas9 note come “nickasi” che hanno preso di mira solo un filamento di DNA invece di entrambi. Sorprendentemente, gli autori hanno scoperto che tali tagli hanno anche dato luogo a un ripristino di alto livello del colore degli occhi rossi quasi alla pari con le mosche sane normali (non mutate). Hanno trovato una percentuale di successo della riparazione del 50-70% con la nickasi rispetto al solo 20-30% nel taglio a doppio filamento Cas9, che genera anche mutazioni frequenti e prende di mira altri siti in tutto il genoma (le cosiddette mutazioni fuori bersaglio). «Non potevo credere a quanto bene funzionasse il nickase: era completamente imprevisto», ha detto la dottoressa Roy, l'autrice principale dello studio. La versatilità del nuovo sistema potrebbe servire da modello per correggere le mutazioni genetiche nei mammiferi, hanno osservato i ricercatori.
«Non sappiamo ancora come questo processo si tradurrà nelle cellule umane e se possiamo applicarlo a qualsiasi gene», ha affermato il dottor Guichard. «Potrebbero essere necessari alcuni aggiustamenti per ottenere un HTR efficiente per le mutazioni che causano malattie trasportate dai cromosomi umani».
La nuova ricerca estende i precedenti risultati del gruppo nell'editing di precisione con “unità alleliche”, che espandono i principi delle unità geniche con un RNA guida che dirige il sistema CRISPR a tagliare le varianti indesiderate di un gene e sostituirle con una versione preferita del gene.
Una caratteristica fondamentale della ricerca del team è che il loro sistema basato sulla nickasi causa molte meno mutazioni dentro e fuori bersaglio, come è noto per le modifiche CRISPR basate su Cas9 più tradizionali. Dicono anche che una consegna lenta e continua di componenti di nickase per diversi giorni potrebbe rivelarsi più vantaggiosa rispetto alle consegne una tantum.
«Un altro notevole vantaggio di questo approccio è la sua semplicità», ha affermato il dottor Bier. «Si basa su pochissimi componenti e le intaccature del DNA sono 'morbide', a differenza di Cas9, che produce rotture complete del DNA spesso accompagnate da mutazioni».
«Se aumentasse la frequenza di tali eventi promuovendo l'accoppiamento interomologo o ottimizzando i processi di riparazione specifici del nick, tali strategie potrebbero essere sfruttate per correggere numerose mutazioni che causano malattie dominanti o trans-eterozigoti», ha affermato la dottoressa Roy.
L'elenco completo degli autori dell'articolo pubblicato da Science Advances: Sitara Roy, Sara Sanz Juste, Marketta Sneider, Ankush Auradkar, Carissa Klanseck, Zhiqian Li, Alison Henrique Ferreira Julio, Victor Lopez del Amo, Ethan Bier e Annabel Guichard.Il supporto per la ricerca è stato fornito dal National Institutes of Health (sovvenzione R01 GM117321), dal Paul G. Allen Frontiers Group Distinguished Investigators Award e un regalo dai Tata Trusts in India al Tata Institute.
Riferimenti:
(1) Annabel Guichard
(2) Ethan Bier
Descrizione foto: Modifica genetica riparativa utilizzando le sequenze del cromosoma della controparte: l'enzima CRISPR standard Cas9 offre la capacità di effettuare riparazioni ma potenzialmente provoca anche mutazioni indesiderate (eventi mutageni) nel sito target e possibilmente in altre parti del genoma (a sinistra). Al contrario, l'enzima nickasi determina una correzione genica più efficiente e nessun evento mutageno (a destra). - Credit: Guichard/Bier.
Autore traduzione riassuntiva e adattamento linguistico: Edoardo Capuano / Articolo originale: “Soft” CRISPR May Offer a New Fix for Genetic Defects
