- In:
- Posted By: Capuano Edoardo
- Commenti: 0
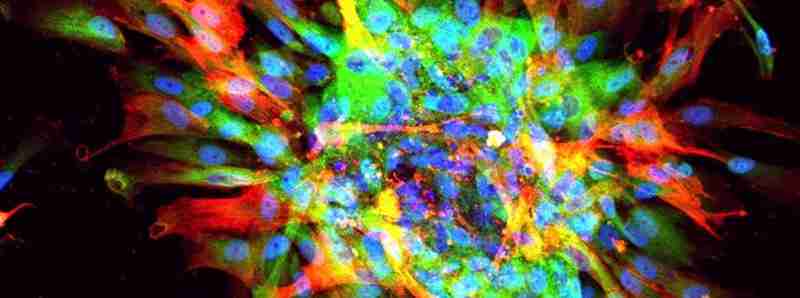
I ricercatori creano un modello accurato di cicatrici d'organo utilizzando cellule staminali in un laboratorio. Questa procedura potrebbe aiutare a identificare i farmaci per il trattamento della fibrosi.
Ogni organo del corpo è in grado, in una certa misura, di ripararsi dopo una lesione. Come parte di questo processo, il tessuto cicatriziale si forma e poi si allontana per fare spazio al tessuto normale quando la guarigione è completa. Tuttavia, quando la guarigione viene interrotta, ad esempio a causa di lesioni croniche o malattie, le cellule che compongono il tessuto cicatriziale possono mutare le loro funzioni, dividendosi e diffondendosi continuamente fino a strangolare l'organo che dovevano aiutare a guarire. Questa mutazione forma una cicatrice progressiva, fuori controllo, che viene chiamata fibrosi e può verificarsi in qualsiasi organo del corpo. La fibrosi svolge un ruolo importante in molte malattie e condizioni, tra cui malattie renali croniche, cirrosi epatica, fibrosi polmonare idiopatica, sclerodermia e insufficienza cardiaca.
«Milioni di persone che vivono con la fibrosi hanno a disposizione opzioni terapeutiche molto limitate», ha affermato la dottoressa Brigitte Gomperts, (1) membro dell'Eli e Edythe Broad Center of Regenerative Medicine and Stem Cell Research presso l'University of California - Los Angeles Health Sciences. «Nel momento in cui le cicatrici sfuggono al controllo, non abbiamo alcun trattamento che possa fermare questo processo, ad eccezione del trapianto di organi interi.»
Per decenni, i ricercatori hanno cercato una terapia in grado di arrestare o invertire la fibrosi, ma uno dei principali blocchi è stata la difficoltà di replicare la natura complessa e progressiva della malattia in laboratorio, in cui i possibili trattamenti potevano essere testati. Ora, un team guidato dalla dottoressa Brigitte Gomperts ha sviluppato un modello denominato “scar in a dish” che utilizza più tipi di cellule derivate da cellule staminali umane per imitare da vicino le cicatrici progressive che si verificano negli organi umani. I ricercatori hanno utilizzato questo modello per identificare un candidato al farmaco che ha fermato la progressione e persino invertito la fibrosi nei modelli animali. Il loro studio è stato pubblicato su Cell Reports. (2)
Il modello è stato creato utilizzando cellule staminali indotte o iPS cells, che sono generate riprogrammando la pelle adulta o le cellule del sangue in uno stato simile allo stelo dal quale possono generare qualsiasi tipo di cellula. Tradizionalmente, quando le iPS cells vengono utilizzate per modellare cicatrici e altri disturbi, vengono prima indotte a produrre un tipo di cellula specifica attraverso un processo chiamato differenziazione diretta. Per generare il loro modello, Brigitte Gomperts e i suoi colleghi hanno adottato un approccio diverso: hanno lasciato che le loro iPS cells facessero ciò che le cellule staminali farebbero normalmente nel corpo umano, ovvero produrre una gamma di tipi di cellule.
«Probabilmente la fibrosi si verifica a seguito di interazioni tra più tipi di cellule diverse, quindi non pensavamo che avesse senso usare solo un tipo di cellula per generare un modello cicatriziale», ha dichiarato la dottoressa Preethi Vijayaraj, (3) primo autore dello studio e assistente professore aggiunto di ematologia / oncologia pediatrica presso la David Geffen School of Medicine dell'UCLA e un membro dell'UCLA Jonsson Comprehensive Cancer Center.
La miscela risultante contiene molti tipi di cellule che si ritiene abbiano un ruolo nella fibrosi, tra cui cellule mesenchimali, cellule epiteliali e cellule immunitarie. Tutte le cellule della miscela hanno mantenuto un certo grado di plasticità, il che significa che avevano la capacità di cambiare le tipologie di cellule, da una cellula epiteliale a una cellula mesenchimale, per esempio. Il modello della dottoressa Brigitte Gomperts è il primo a ricreare quella plasticità, un segno distintivo della fibrosi progressiva.
Con tutti i tipi di cellule chiave coinvolti nella fibrosi, il team ha portare a termine il processo delle cicatrici. Per fare ciò, i ricercatori hanno posizionato la miscela cellulare su un idrogel rigido che ha ricreato la rigidità approssimativa di un organo sfregiato. Le cellule hanno risposto allo stesso modo in cui rispondono alle lesioni nel corpo, producendo segnali di lesioni o danni e attivando una molecola trasformando il fattore di crescita beta, o TGF beta, che funge da scintilla che scatena il fuoco scoppiettante della fibrosi.
In passato, quando i ricercatori crearono modelli in laboratorio per la fibrosi, utilizzarono un tipo di cellula - solitamente cellule mesenchimali - a cui aggiunsero TGF beta per provocare cicatrici. Poiché il TGF beta fu aggiunto dagli scienziati (e non prodotto dalle cellule stesse in risposta a un infortunio), quegli esperimenti generarono modelli che tendevano a guarire da soli, il che rendeva difficile capire se i possibili trattamenti funzionavano o il modello rappresentava semplicemente una guarigione.
Usando l'idrogel per simulare lesioni e provocare la produzione di TGF beta, il team della dottoressa Gomperts ha assicurato che il suo modello non era in grado di guarire se stesso; finché le cellule sono rimaste sull'idrogel, hanno percepito una “lesione” e hanno continuato a cicatrizzare progressivamente. Ciò ha dato ai ricercatori la rara opportunità di testare i candidati per la terapia su una cicatrice che non era attivamente impegnata nella guarigione stessa.
Dopo aver confermato che il nuovo modello ha ricreato accuratamente la fibrosi negli organi umani, il team ha deciso di identificare i farmaci che potrebbero arrestare o invertire il processo. Hanno testato più di 17.000 piccole molecole - composti organici che sono spesso usati per creare farmaci. Il team ha identificato una piccola molecola che ha fermato le cicatrici progressive e ha persino guarito il danno che aveva causato. I ricercatori sospettano che la molecola funzioni attivando i processi intrinseci di guarigione delle ferite delle cellule.
la dottoressa Brigitte Gomperts, che è anche professoressa di pediatria e medicina polmonare presso la Geffen School of Medicine e membro del Jonsson Cancer Center, spiega: «Questo candidato al nuovo protocollo terapeutico sembra essere in grado di fermare e invertire le cicatrici progressive abbattendo effettivamente il tessuto cicatriziale. Lo abbiamo testato su modelli animali di fibrosi dei polmoni e degli occhi e abbiamo scoperto che ha promesso di trattare entrambe queste malattie.»
Proseguendo le ricerche, il team ha in programma di definire in che modo quel candidato al nuovo protocollo terapeutico inverte le cicatrici e seleziona ulteriori piccole molecole per comprendere meglio la malattia e identificare nuove possibile strategie.
Lo studio è stato finanziato dall'UCLA Children's Discovery and Innovation Institute e dall'UCLA Broad Stem Cell Research Center, compreso il sostegno della Steffy Family Foundation.La terapia sperimentale, testata dai ricercatori, è stata utilizzata solo nei test preclinici e non è stata testata sull'uomo o approvata dalla Food and Drug Administration come sicura ed efficace per l'uso nell'uomo. La strategia terapeutica appena identificata è coperta da una domanda di brevetto presentata dall'UCLA Technology Development Group per conto dei Reggenti dell'Università della California, con la dottoressa Brigitte Gomperts e la dottoressa Preethi Vijayaraj come co-inventori. La dottoressa Brigitte Gomperts è co-fondatore e azionista di InSpira LLC, una società fondata per sviluppare questa strategia terapeutica per la fibrosi.
Riferimenti:
(2) Modeling Progressive Fibrosis with Pluripotent Stem Cells Identifies an Anti-fibrotic Small Molecule
Descrizione foto: immagine microscopica di cicatrici in un piatto, che mostra evidenza di fibrosi (rosso, verde) e nuclei di tutte le cellule (blu). - Credit: UCLA Broad Stem Cell Research Center/Cell Reports.
Autore traduzione riassuntiva e adattamento linguistico: Edoardo Capuano / Articolo originale: Researchers create accurate model of organ scarring using stem cells in a lab
