- In:
- Posted By: Capuano Edoardo
- Commenti: 0
Uno studio clinico randomizzato e controllato per valutare la sicurezza e l'efficacia del Remdesivir, antivirale sperimentale negli adulti ospedalizzati con diagnosi di coronavirus 2019 (COVID-19), è iniziato presso l'University of Nebraska Medical Center (UNMC) di Omaha.
Lo sponsor normativo del processo è l'Istituto Nazionale di allergie e malattie infettive (NIAID), parte del National Institutes of Health. Questo è il primo studio clinico negli Stati Uniti per valutare un trattamento sperimentale per COVID-19, la malattia respiratoria rilevata per la prima volta nel dicembre 2019 a Wuhan, nella provincia di Hubei, in Cina.
Il primo partecipante al processo è un americano che è stato rimpatriato dopo essere stato messo in quarantena sulla nave da crociera Diamond Princess che ha attraccato a Yokohama, in Giappone, e si è offerto volontario per partecipare allo studio. Lo studio può essere adattato per valutare ulteriori trattamenti investigativi e per arruolare partecipanti in altri siti negli Stati Uniti e in tutto il mondo.
Non esistono terapie specifiche approvate dalla Food and Drug Administration (FDA) per curare le persone con COVID-19, la malattia causata dal nuovo virus SARS-CoV-2 (precedentemente noto come 2019-nCoV). L'infezione può causare malattie respiratorie da lievi a gravi e i sintomi possono includere febbre, tosse e respiro affannoso. Il 24 febbraio, l'Organizzazione mondiale della sanità (OMS) ha riportato 77.262 casi confermati di COVID-19 e 2.595 decessi in Cina e 2.069 casi di COVID-19 e 23 decessi in 29 altri paesi. Ci sono stati 14 casi confermati di COVID-19 segnalati negli Stati Uniti e altri 39 casi tra persone rimpatriate negli Stati Uniti, secondo i Centers for Disease Control and Prevention (CDC). (1)
Il farmaco remdesivir, sviluppato da Gilead Sciences Inc., è un trattamento antivirale ad ampio spettro sperimentale. È stato precedentemente testato su esseri umani con malattia da virus Ebola e ha mostrato risultati promettenti in modelli animali per il trattamento della sindrome respiratoria del Medio Oriente (MERS) (2) e della sindrome respiratoria acuta grave (SARS), che sono causate da altri coronavirus.
«Abbiamo urgentemente bisogno di un trattamento sicuro ed efficace per COVID-19. Sebbene remdesivir sia stato somministrato ad alcuni pazienti con COVID-19, non disponiamo di dati solidi per indicare che può migliorare gli esiti clinici», ha dichiarato il Direttore NIAID e il membro della Task Force statunitense Coronavirus Anthony S. Fauci, MD (3) «Uno studio randomizzato, controllato con placebo, è il gold standard per determinare se un trattamento sperimentale può essere di beneficio ai pazienti.»
In Cina sono in corso anche studi clinici su Remdesivir. NIAID ha sviluppato l'attuale studio tenendo conto di tali progetti e in conformità con le consultazioni convocate dall'OMS sullo sviluppo di uno studio terapeutico per pazienti con COVID-19.
I partecipanti allo studio, sponsorizzato da NIH, devono avere un'infezione SARS-CoV-2 confermata in laboratorio e la prova del coinvolgimento polmonare, compresa una respirazione anormale (rantoli) con necessità di ossigeno supplementare o radiografie del torace anormali o malattie che richiedono ventilazione meccanica. Gli individui con infezione confermata che presentano sintomi lievi, simili al raffreddamento o che non presentano sintomi apparenti non saranno inclusi nello studio. In conformità con i protocolli standard di ricerca clinica, i pazienti idonei forniranno il consenso informato per partecipare alla sperimentazione.
Tutti i potenziali partecipanti saranno sottoposti a un esame fisico di base prima di ricevere il trattamento. I partecipanti allo studio ammissibili verranno quindi assegnati in modo casuale al gruppo di trattamento sperimentale o al gruppo placebo. Lo studio è in doppio cieco, il che significa che gli investigatori della sperimentazione e i partecipanti non sanno chi sta ricevendo Remdesivir o placebo. I partecipanti al gruppo di trattamento sperimentale riceveranno 200 milligrammi (mg) di Remdesivir per via endovenosa il primo giorno di iscrizione allo studio. Riceveranno altri 100 mg ogni giorno per la durata del ricovero, per un totale massimo di 10 giorni. Il gruppo placebo riceverà, a parità di volume, una soluzione che ricorda Remdesivir ma contenente solo ingredienti inattivi.
I medici monitoreranno regolarmente i partecipanti e assegneranno loro punteggi giornalieri basati su una scala predefinita di risultati clinici che considera, tra gli altri, fattori quali la temperatura, la pressione sanguigna e l'uso di ossigeno supplementare. Ai partecipanti verrà inoltre chiesto di fornire campioni di sangue e tamponi di naso e gola ogni due giorni circa. I ricercatori testeranno questi campioni per SARS-CoV-2.
Inizialmente, i ricercatori confronteranno i risultati dei partecipanti il giorno 15 marzo sia nel gruppo Remdesivir che nel gruppo placebo per verificare se il farmaco sperimentale ha aumentato il beneficio clinico rispetto al placebo. I risultati sono segnati su una scala di sette punti che vanno dal recupero completo fino alla morte. Gli investigatori rivaluteranno questa scala dopo aver esaminato i dati dei primi 100 partecipanti.
Un comitato indipendente di monitoraggio dei dati e della sicurezza (DSMB) monitorerà i risultati in corso per garantire il benessere e la sicurezza del paziente, nonché l'integrità dello studio. Il DSMB raccomanderà di interrompere lo studio se vi sono prove chiare e sostanziali di una differenza di trattamento tra farmaco e placebo.
Il dottor Andre Kalil, M.D., (4) professore di medicina interna presso l'University of Nebraska Medical Center e medico di malattie infettive presso la Nebraska Medicine, sta conducendo il monitoraggio presso l'ateneo. Tredici persone rimpatriate dal Dipartimento di Stato degli Stati Uniti dalla nave da crociera Diamond Princess sono state trasportate all'unità nazionale di quarantena, situata all'interno del Centro di addestramento, simulazione e quarantena nel campus UNMC / Nebraska Medicine a Omaha il 17 febbraio 2020. I passeggeri erano in un ambiente vicino in cui vi era stata una significativa diffusione di COVID-19 e sono stati inviati all'unità per il continuo isolamento e possibilmente ulteriore cura. Da allora il CDC ha riferito che 11 persone nell'unità UNMC hanno confermato l'infezione SARS-CoV-2.
L'Unità nazionale di quarantena dell'University of Nebraska Medical Center (UNMC) è supportata dall'ufficio dell'Assistant Secretary for Preparedness and Response (ASPR) (5) presso il Dipartimento della salute e dei servizi umani. Ha una capacità di 20 letti ed è nelle immediate vicinanze dell'unità di biocontenimento del Nebraska ( Nebraska Biocontainment Unit), (6) nel caso in cui fosse necessario un livello di assistenza più elevato. I partecipanti alla sperimentazione clinica sono assistiti nell'unità di biocontenimento.
«Ringraziamo le persone per la loro partecipazione a questo processo e siamo lieti che il NIH abbia scelto l'University of Nebraska Medical Center (UNMC) come sito per questo importante lavoro», ha affermato il dott. Kalil. «La nostra esperienza nel trattamento di malattie altamente infettive, così come la nostra capacità di condurre studi clinici all'avanguardia, garantirà che questo studio sia condotto nel modo più efficace possibile».
Riferimenti:
(1) Coronavirus Disease 2019 (COVID-19) in the U.S.
(2) Remdesivir Prevents MERS Coronavirus Disease in Monkeys
(3) Anthony S. Fauci
(4) Andre Kalil
(5) HHS Office of the Assistant Secretary for Preparedness and Response
(6) Nebraska Biocontainment Unit
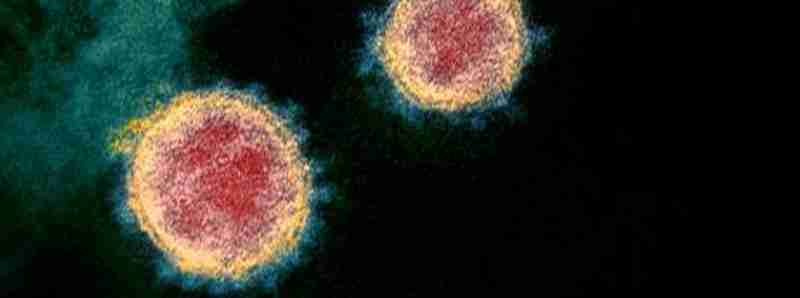
Descrizione foto: questa immagine al microscopio elettronico a trasmissione mostra SARS-CoV-2 — noto anche come 2019-nCoV, il virus che causa COVID-19 — isolato da un paziente negli Stati Uniti. Vengono mostrate particelle di virus che emergono dalla superficie delle cellule coltivate in laboratorio. I picchi sul bordo esterno delle particelle virali danno ai coronavirus il loro nome, simile a una corona. - Credit: NIAID RML
Autore traduzione riassuntiva e adattamento linguistico: Edoardo Capuano / Articolo originale: NIH Clinical Trial of Remdesivir to Treat COVID-19 Begins
