- In:
- Posted By: Capuano Edoardo
- Commenti: 0
Creato un nuovo protocollo generalizzato economicamente vantaggioso per la preparazione e la visualizzazione delle cellule vegetali.
Gli scienziati hanno fatto molta strada da quando il naturalista olandese Antoni van Leeuwenhoek, (1) scrutando attraverso i suoi microscopi, scopri colonie brulicanti di batteri invisibili e protozoi.
L'architettura di cellule, organelli, proteine e persino molecole è stata illuminata attraverso l'albero della vita. Eppure, nonostante questi progressi, le barriere del mondo microscopico devono ancora essere mappate in modo completo. Prima di poter essere visualizzati sotto un microscopio, i tessuti e i componenti cellulari devono prima essere macchiati con coloranti e fissativi per poi essere sottoposti a un lungo processo di preparazione.
In un nuovo studio, pubblicato su Applications in Plant Sciences, (2) gli scienziati avvalorano la necessità di colorazione del campione toccando nella naturale autofluorescenza dei tessuti in specie botaniche attraverso l'albero della pianta della vita.
«Il nostro lavoro fornisce un protocollo generalizzato economicamente vantaggioso per la preparazione e la visualizzazione dei campioni di piante che è ugualmente applicabile a tutti gli istituti botanici di ricerca», ha affermato il dottor Timothy Pegg, (3) autore dello studio e assistente professore presso il Marietta College.
Quando determinati tipi di tessuto in piante e animali assorbono la luce, gli elettroni nei loro atomi hanno una scossa di energia che li imbattono in uno stato eccitato. Nelle foglie di piante, questi elettroni diventano così instabili che si liberano dai loro atomi e sono usati dalla pianta alla potenza fotosintesi. In altri tessuti, l'energia in eccesso viene riemessa sotto forma di luce a bassa frequenza abbastanza luminosa da essere rilevata con speciali microscopi.
L'autofluorescenza non è sempre stata accettata in maniera positiva. Nei casi in cui i ricercatori devono usare le macchie per visualizzare strutture specifiche, le proprietà che emette la luce dei tessuti nelle vicinanze possono interferire diminuendo il contrasto tra diversi tipi di cellule.
Ma può anche essere una risorsa indispensabile per la scoperta. L'autofluorescenza è stata utilizzata per rilevare tumori in anticipo, nonché altre malattie e patologie. È stata anche impiegata per studiare come gli insetti usano le lingue e le antenne per assaggiare il cibo; i meccanismi sottostanti la rigenerazione della coda nelle lucertole e analizzare la diversità del plancton microscopico negli ambienti marini.
L'autofluorescenza è ugualmente utile nelle piante, dove si presenta in tutto, dai tessuti rigidi che danno alle piante legnose la loro stabilità, al residuo composto da particelle dell'acqua che copre spore e polline, al vario arsenale delle piante di composti tossici prodotti per proteggersi dai predatori.
Tuttavia, i ricercatori non hanno ancora mancato un protocollo con un solo formato per rilevare la luce autofluorescente nelle piante. La mancanza di un approccio unificato e standard è comprensibile, dato che ci sono quasi mezzo milione di specie viventi di piante terrestri e alghe, ma il dottor Timothy Pegg e i suoi colleghi sono rimasti determinati. Hanno selezionato 12 specie da diversi gruppi di impianti chiave separati da oltre 500 milioni di anni di storia evolutiva, tra cui pini, bryophyte, piante da fiore e alghe.
Usando questi rappresentanti, hanno sviluppato un metodo economicamente efficiente di conservazione del tessuto senza la necessità di macchie o coloranti.
Mentre l'autofluorescenza può spesso essere visualizzata direttamente con microscopi confocali, può anche essere indotta o migliorata con diversi fissativi, compresi alcol, etanolo e composti chiamati aldeidi. Il dottor Timothy Pegg e i suoi colleghi hanno scelto cinque dei più efficaci tra questi per testare i loro esemplari vegetali. Dopo aver marinato in un fissativo per 24 ore, le piante sono state sciacquate, tagliate alla larghezza di un capello umano e montate su un diapositivo trasparente per la visualizzazione.
Quando i ricercatori osservano attraverso il microscopio, il mondo in miniatura di cellule vegetali e organelli è stato portato a una focalizzazione acuta. Le righe rigide che compongono le linee di pareti cellulari si sono distinte in bassorilievo dalla clorofilla strettamente imballata all'interno. Scrutando su particolari lunghezze d'onda della luce emessa dalle proteine, si potrebbero distinguere tra le dense caratteristiche dei nuclei e il tessuto di conduzione dell'acqua e dello zucchero che si propagano tra le cellule.
La maggior parte dei fissativi si sono esibiti bene nelle piante rappresentative, con risultati sorprendenti, ma le alghe hanno dimostrato di essere un'eccezione. La maggior parte delle piante terrestri ha pareti cellulari spesse che aiutano a prevenire la perdita d'acqua fornendo un sostegno strutturale, qualità che manca alle alghe. A causa della conformazione della loro struttura base, l'etanolo e i fissativi dell'alcol penetrano rapidamente le pareti cellulari delle alghe e della Marchantiophyta (una pianta strettamente legata ai muschi), anch'essa utilizzata nello studio, causando gli organelli di rughe e innescando un processo di deformazione. Per questi esemplari, il dottor Timothy Pegg raccomanda di attaccare ai fissativi di Aldeide o riducendo la quantità di tempo utilizzata nelle fasi di preparazione del campione.
La maggior parte dei laboratori di ricerca sono sprovvisti di microscopi confocali ad alta potenza necessari per visualizzare le strutture cellulari a scale fini. Per utilizzare le apparecchiature, questi laboratori sono costretti a noleggiarle a pagamento. Un problema che Timothy Pegg e i suoi colleghi sperano di risolvere.
«La nostra semplice tecnica di preparazione del campione può ridurre le tempistiche per la sua visualizzazione su microscopi avanzati», ha affermato il dottor Robert Baker, assistente professore di biologia presso la Miami University e autore senior dello studio.
Tutte le sostanze chimiche e i reagenti utilizzati nello studio sono altrettanto poco costosi e prontamente disponibili, il che significa che quasi chiunque in un istituto di ricerca può utilizzare questo protocollo per studiare interazioni subcellulari nelle piante.
Applications in Plant Sciences (APPS)È un giornale mensile, peer-reviewed, ad accesso aperto incentrato su nuovi strumenti, tecnologie e protocolli in tutte le aree delle scienze delle piante. È pubblicato dalla Botanical Society of America, (4) una società di appartenenza non profit con una missione per promuovere la botanica, il campo della scienza di base che si occupa dello studio e dell'inchiesta nella forma, nella funzione, nello sviluppo, della diversità, della riproduzione, evoluzione e usi delle piante e le loro interazioni all'interno della biosfera.
Riferimenti:
(2) Algae to angiosperms: Autofluorescence for rapid visualization of plant anatomy among diverse taxa
(3) Timothy Pegg
(4) Botanical Society of America
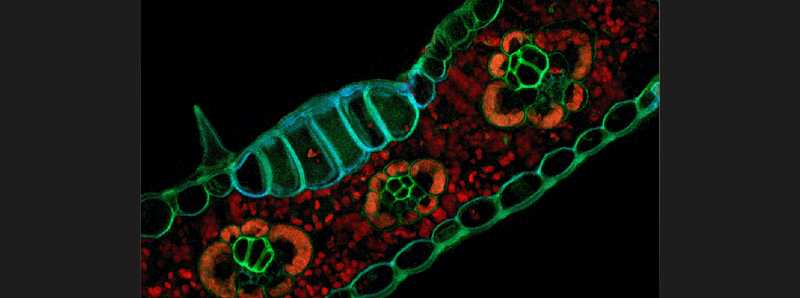
Descrizione foto: La fissazione di formaldeide migliora i modelli di fluorescenza dei tessuti all'interno dei sezioni trasversali di foglia di mais (Zea Mays). Il trattamento con una soluzione fissativa paraformaldeide ha rivelato una distintiva fluorescenza blu/verde di epidermide, trichomi, xilem, floem e cellule bulliformi derivanti dalla fluorescenza indotta dall'aldeidica. In confronto, la rossa autofluorescenza della clorofilla è stata osservata in celle guaine del fascio e mesofill di sezioni trasversali a foglie. L'acquisizione dell'immagine richiede solo attrezzature specializzate minime sotto forma di microscopi capaci a fluorescenza. - Credit: Timothy J. Pegg. - License: CC BY-NC-SA.
Autore traduzione riassuntiva e adattamento linguistico: Edoardo Capuano / Articolo originale: Algae to angiosperms: Autofluorescence for rapid visualization of plant anatomy among diverse taxa
