- In:
- Posted By: Capuano Edoardo
- Commenti: 0
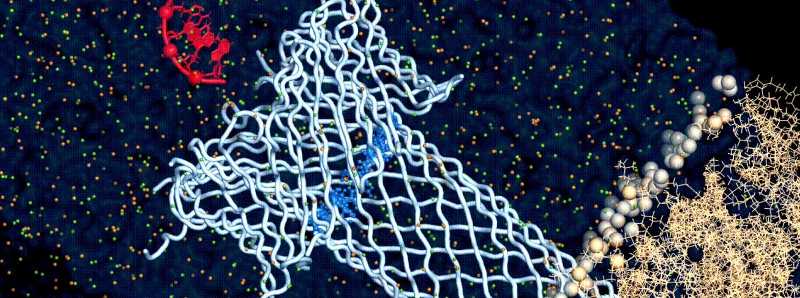
Simulazione molecolare di un poro della tossina aerolysin ingegnerizzata incorporato in un doppio strato di membrana e DNA traslocante.
Alcuni tipi di batteri hanno la capacità di praticare buchi in altre cellule e ucciderle. Lo fanno rilasciando proteine specializzate chiamate “pore-forming toxins” (PFTs) che si agganciano alla membrana cellulare e formano un canale simile a un tubo che lo attraversa. Forata da più PFTs, la cellula bersaglio si autodistrugge.
Tuttavia, le PFTs hanno suscitato molto interesse nell'ambito delle infezioni batteriche. I pori di dimensioni nanometriche che si formano vengono utilizzati per “rilevare” le biomolecole: una molecola biologica e.g. DNA oppure RNA, attraversa il nanoporo come una stringa guidata da una tensione e i suoi singoli componenti (ad esempio acidi nucleici nel DNA) emettono segnali elettrici distinti che possono essere letti. In effetti, il rilevamento dei nanopori è già sul mercato come uno strumento importante per il sequenziamento del DNA o dell'RNA.
Lo studio è stato pubblicato su Nature Communications, (1). Gli scienziati, guidati da Matteo Dal Peraro (2) dell'Ecole Polytechnique Fédérale de Lausanne (EPFL), hanno studiato un altro importante PFTs che può essere utilizzato in modo efficace per un rilevamento più complesso, come il sequenziamento delle proteine. La tossina si chiama aerolysin, (3) che è prodotta dal batterio Aeromonas hydrophila, e rappresenta il 'membro fondatore' di una grande famiglia di PFTs che si trova in molti organismi.
Uno dei principali vantaggi dell'aerolysin è che forma pori molto stretti che possono distinguere molecole con una risoluzione molto più elevata rispetto alle altre tossine. Precedenti studi hanno dimostrato che l'aerosol può essere usato per rilevare diverse biomolecole, ma non esistono studi mirati sulla relazione tra la struttura dell'aerosol e le sue capacità di rilevamento molecolare.
I ricercatori hanno inizialmente utilizzato un modello strutturale di aerolysin per studiare la sua struttura con simulazioni al computer. Come proteina, l'aerosol è formata da aminoacidi e il modello ha aiutato gli scienziati a capire come quegli aminoacidi influenzano la funzione dell'aerosol in generale.
Nel momento in cui hanno hanno compreso quella relazione, i ricercatori hanno iniziato a cambiare strategicamente diversi aminoacidi nel modello al computer. Il modello ha quindi previsto il possibile impatto di ogni modifica sulla funzione generale dell'aerolysin.
Alla fine del processo computazionale, la dottoressa Chan Cao, (4) autore principale di questo lavoro, ha prodotto sedici pori di aerolisina 'mutanti' ingegnerizzati geneticamente, li ha incorporati in doppi strati lipidici per simulare la loro posizione in una membrana cellulare ed ha effettuato varie misurazioni (esperimenti di registrazione a canale singolo e traslocazione molecolare) per capire come la conduttanza ionica, la selettività ionica e le proprietà di traslocazione del poro dell'aerolysin sono regolate a livello molecolare.
Grazie a questo studio, gli scienziati hanno finalmente scoperto ciò che guida la relazione tra la struttura e la funzione dell'aerolysin: il suo cappuccio. Il poro dell' aerolysin non è solo un tubo che attraversa la membrana, ma ha anche una struttura a forma di tappo che attira e tinge la molecola bersaglio e la 'tira' attraverso il canale del poro. Questo studio ha scoperto che sono gli elettrostatici in questa regione del cappello a dettare questa relazione.
Riferimenti:
(1) Single-molecule sensing of peptides and nucleic acids by engineered aerolysin nanopores
(2) Matteo Dal Perar
(3) aerolysin
(4) Chan Cao
Descrizione foto: simulazione molecolare di un poro di aerolysin ingegnerizzata (colore blu chiaro) incorporato in un doppio strato di membrana (color crema) e DNA traslocante (colore rosso). - Credit: Chan Cao, EPF. - Usage Restrictions: solo per scopi multimediali. Uso commerciale limitato; solo su autorizzazione.
Autore traduzione riassuntiva e adattamento linguistico: Edoardo Capuano / Articolo originale: Turning a dangerous toxin into a biosensor
