- In:
- Posted By: Claudio Messori
- Commenti: 0
In data 10 gennaio 2020 il primo sequenziamento del genoma del nuovo coronavirus viene reso pubblicamente disponibile e depositato nel database GenBank per essere caricato nella Global Initiative on Sharing All Influenza Data.
Grazie al lavoro congiunto di un team di ricercatori cinesi e australiani, in data 10 gennaio 2020 il primo sequenziamento del genoma del nuovo coronavirus viene reso pubblicamente disponibile e depositato nel database GenBank per essere caricato nella Global Initiative on Sharing All Influenza Data (GISAID) (1) [7]. La disponibilità del sequenziamento del nuovo coronavirus apre nuovi scenari e alimenta speranze, soprattutto rispetto alla realizzazione di un vaccino. Diversi centri di ricerca pubblici e privati afferenti al settore farmaceutico in varie parti del mondo avevano da tempo avviato, anche in previsione di una pandemia da coronavirus, programmi di ricerca rivolti alla realizzazione di nuove tipologie di vaccini, in particolare una nuova generazione di vaccini basati su avanzate tecniche di bio-ingegnerizzazione genica [8], chiamati vaccini genetici, molto più veloci e meno costosi da realizzare.
Con questa premessa e l’allettante prospettiva di aggiudicarsi guadagni miliardari dal nascente business dei vaccini anti-COVID-19, le Case farmaceutiche più avvantaggiate, incentivate anche dalla disponibilità di ingenti finanziamenti pubblici (circa 88,3 miliardi di euro nel corso del 2020, di cui il 32% dagli Stati Uniti, il 24% dall’Unione Europea e il 13% dai governi di Giappone e Corea del Sud), (2) in pochi mesi (rispetto ai consueti, almeno in occidente, 10-15 anni) sono riuscite a realizzare (fase pre-clinica), testare (fase I-II-III di sperimentazione clinica), superare i test di validazione, ottenere la licenza e commercializzare (fase IV post-marketing – Fig. 1) i tanto agognati vaccini anti-COVID-19, detenendone il brevetto.
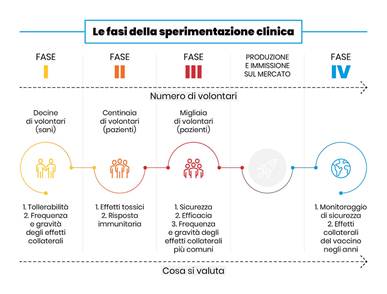
Fig. 1
Le fasi della sperimentazione clinica di un vaccino.
Fonte immagine: Università Vita-Salute San Raffaele, I vaccini contro Covid-19: a che punto siamo?
LEGGI QUI: I vaccini contro Covid-19: a che punto siamo?. (versione PDF)
Alla data dell’8 marzo 2021 si contavano 204 vaccini anti-COVID-19, (3) di cui 122 in fase pre-clinica, 77 in fase I di sperimentazione clinica, 48 in fase II, 26 in fase III e 7 in fase IV, (4) appartenenti a quattro tipologie diverse di vaccini, (5) tra cui 28 vaccini genetici che sfruttano l’impiego di Organismi Geneticamente Modificati (secondo la definizione standard sono OGM gli organismi, inclusi i virus, nel cui DNA o RNA sono stati inseriti geni estranei, cioè di altre specie o sintetici), di cui 7 a RNA sintetico, 7 a DNA sintetico e 14 classificati come vaccini vettoriali.
Ecco in sintesi le diverse tipologie di vaccini anti-COVID-19:
• Vaccini genetici:
- Tecnologia a RNA sintetico. Appartengono a questa tipologia il vaccino della tedesco-statunitense Pfizer/BioNTech (6) e quello dell’americana Moderna, (7) entrambi in fase IV ed entrambi finanziati direttamente dagli USA, e quello della tedesca CureVac (8) (al 15 marzo 2021 in fase III di sperimentazione clinica). Il vaccino non contiene il virus ma attraverso una sequenza di mRNA (RNA messaggero) (9) sintetizzata in laboratorio incapsulato in minuscole particelle lipidiche induce i ribosomi delle cellule somatiche entro cui penetra (Fig. 2), in particolare quelle vicine al sito di inoculazione (muscolo deltoide), a produrre la proteina “spike” (Sars-Cov-2 entra nelle cellule umane grazie a proteine virali che si trovano sulla sua superficie, le “spike” che agganciano una proteina specifica umana, la ACE2, presente sulla superficie delle cellule del naso, dei polmoni e di vari altri organi) (10) i cui antigeni, essendo anomali e potenzialmente dannosi, scatenano una serie di reazioni di difesa (con l’eventuale comparsa di sintomi tipici della malattia o di reazioni di tipo allergico) inducendo il sistema immunitario a produrre gli anticorpi e le cellule T che combatteranno la vera infezione da coronavirus quando e se arriverà.
- Tecnologia a DNA sintetico. Appartiene a questa tipologia il vaccino nCov (al 15 marzo 2021 in fase III di sperimentazione clinica) della canadese Cadila Healthcare. Il vaccino agisce sulla base dello stesso principio di quello a mRNA sintetico (indurre la produzione di proteine spike) tranne che contiene DNA sintetico e per penetrare nelle cellule somatiche utilizza plasmidi di DNA come vettore.
- Vaccini vettoriali. Per penetrare nelle cellule somatiche questi vaccini utilizzano un vettore virale (di solito un adenovirus - Ad) vivo o inattivato, non replicante o replicante, umano o non umano, nel cui DNA è stato inserito il gene della glicoproteina a tutta lunghezza S SARS-CoV-2 che codifica per la proteina S spike. Appartengono a questa tipologia i) il vaccino anglo-svedese di Oxford-AstraZeneca (11) (in fase IV), finanziato dal governo britannico, che per penetrare nelle cellule somatiche utilizza un vettore virale (adenovirus) inattivato non replicante di scimpanzé, ii) il vaccino americano Johnson & Johnson (12) (in fase IV) che per penetrare nelle cellule somatiche utilizza un vettore virale inattivato (adenovirus) non replicante umano, e iii) il vaccino vettoriale combinato russo Sputnik V [9] (per gli standard europei a marzo 2021 in fase III), che per penetrare nelle cellule somatiche utilizza due tipi di adenovirus [10] con deficit di replicazione ricombinante (rAd), ovvero rAd di tipo 26 (rAd26) e rAd di tipo 5 (rAd5), entrambi portatori del gene della glicoproteina a tutta lunghezza S SARS-CoV-2 (rAd26-S e rAd5-S), che vengono somministrati per via intramuscolare separatamente con un intervallo di 21 giorni. L’efficacia del ricorso a un adenovirus umano come vettore è subordinata alla eventuale preesistenza di anticorpi per quel vettore e alla conseguente risposta immunitaria (l'immunità preesistente contro Ad5 umano, per es., è diffusa, ed ostacola il suo utilizzo come vettore per lo sviluppo di vaccini, come osservato nel trial del vaccino vettoriale cinese Ad5-nCoV che per esprimere la proteina Spike del SARS-CoV-2 utilizza appunto l’adenovirus inattivato umano di tipo 5 - Ad5 [11]. Poiché gli adenovirus trasportano il loro genoma nel nucleo della cellula ospite per la trascrizione e la replicazione, esiste il rischio di integrazione genomica, anche se il vettore tende a rimanere prevalentemente episomale [12].
• Vaccini proteici (proteine ricombinanti). Utilizzando la sequenza RNA del coronavirus vengono sintetizzate in laboratorio proteine o frammenti di proteine del capside virale (il rivestimento dell’acido nucleico del virus) [13]. Iniettate nell’organismo con o senza sostanze coadiuvanti che esaltino la risposta immunitaria si induce la risposta anticorpale da parte dell’individuo. Appartengono a questa tipologia il vaccino americano Novavax (13) (al 15 marzo 2021 in fase III di sperimentazione clinica) e il vaccino Covax dell’inglese GlaxoSmithKline (GSK) e della francese Sanofi. (14)
• Vaccini inattivati. Questi vaccini utilizzano il virus SARS-CoV-2 che è stato inattivato con calore, radiazioni o sostanze chimiche, che bloccano completamente la capacità del virus di replicarsi. Appartengono a questa tipologia i vaccini cinesi CoronaVac della Sinovac e il purified inactivated Vero-cell SARS-COV-2.
• Vaccini vivi attenuati. Questi vaccini vengono prodotti utilizzando una versione geneticamente attenuata (indebolita) del virus SARS-CoV-2 che si replica in misura limitata [14]. (15) Il virus è ancora infettivo e induce risposte immunitarie simili a quelle indotte dall'infezione naturale. Appartiene a questa tipologia il vaccino statunitense Nsp16 mutant lacking 2'-OMTase. Va comunque detto che con alcuni vaccini vivi attenuati, come il vaccino contenente il poliovirus orale di Sabin, esiste una remota possibilità che il virus indebolito possa tornare alla sua piena virulenza e causare malattie. Non è noto se questa regressione si verificherà con il vaccino vivo attenuato contro il SARS-CoV-2.
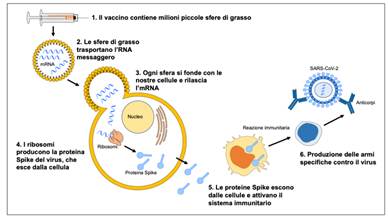
Fig. 2
All'interno del vaccino, l'mRNA è protetto, incapsulato all'interno di sfere fatte di grassi (liposomi), simili a quelli presenti delle nostre cellule. Una volta iniettati nel nostro corpo, i liposomi liberano l'mRNA che contiene le informazioni necessarie per produrre la proteina Spike del virus. L'mRNA che si trova nel vaccino, una volta entrato nelle cellule viene letto dai ribosomi della cellula che produrranno tante copie della proteina Spike del SARS-CoV-2. Una volta che le nostre cellule avranno prodotto la proteina Spike, questa uscirà dalla cellula e verrà riconosciuta come estranea dal sistema immunitario, attivando una reazione immunitaria senza provocare la malattia.
Riferimenti:
(1) Severe acute respiratory syndrome coronavirus 2 isolate Wuhan-Hu-1, complete genome - Clicca qui per la versione PDF
(2) I governi hanno speso almeno 93 miliardi di euro in vaccini e terapie COVID-19 nel corso degli ultimi 11 mesi - Clicca qui per la versione PDF
(3) COVID-19 Vaccine & Therapeutics Tracker
(4) Secondo un’altra fonte, il “COVID-19 vaccine tracker”, al 15 marzo 2021 il numero di vaccini in fase di sperimentazione clinica erano 96, di cui 29 in fase I, 40 in fase II, 27 in fase III e 13 approvati in almeno una nazione. COVID-19 Vaccine Tracker
(5) Per un elenco parziale dei vaccini e di altri approcci contro la COVID-19 vedi anche: Vaccini contro COVID-19: elenco degli studi clinici
(6) Pfizer and BioNTech Conclude Phase 3 Study of COVID-19 Vaccine Candidate, Meeting All Primary Efficacy Endpoints - Clicca qui per la versione PDF
(8) Activities regarding CVnCoV, CureVac's mRNA-based vaccine candidate against COVID-19 COVID-19 - CureVac
(9) L’mRNA di una cellula è una molecola di acido nucleico a filamento singolo che trasporta una sequenza genica dal DNA dei cromosomi contenuti nel nucleo della cellula alle fabbriche di proteine - chiamate ribosomi - che si trovano all'esterno del nucleo, nel citoplasma cellulare. L’mRNA trasporta le istruzioni dal DNA ai ribosomi per l’assemblaggio delle proteine (questo è ciò che significa la "m" nell'mRNA: messaggero). L'mRNA è una molecola intrinsecamente instabile e si degrada rapidamente nei singoli nucleotidi (basi azotate) di cui si compone. Questa elevata instabilità è il motivo per cui viene prestata grande attenzione alla logistica della distribuzione dei vaccini a mRNA. Il vaccino Pfizer-BioNTech rimane stabile in speciali congelatori alla temperatura artica di –70 °C. Il vaccino Moderna rimane stabile in un congelatore standard a –20 °C per un massimo di sei mesi, in frigorifero (a 2-8 °C) per un massimo di 30 giorni e a temperatura ambiente per un massimo di 12 ore. La molecola sintetica di mRNA di questi vaccini non contiene gli enzimi necessari per poter entrare nel DNA e non può entrare nel nucleo cellulare, almeno fino a quando non viene scomposta nei singoli nucleotidi che la compongono. Quindi l'mRNA sintetico del vaccino non può interferire né interagire con il nostro DNA o causare modifiche al genoma. Anche se potesse entrare nel nucleo, il DNA ha meccanismi protettivi per affrontarlo. Tuttavia, i nucleotidi “alieni” prodotti dalla sua degradazione sono riutilizzabili.
(10) Il genoma di SARS-CoV-2 è costituito da un singolo filamento di RNA a polarità positiva (quindi in grado di essere subito tradotto in proteine) di grande taglia (3 volte la lunghezza del genoma di HIV). Quando il virus infetta le cellule ospite, le sfrutta per dare origine a diverse proteine virali; dopodiché lascia la cellula e prosegue con una nuova infezione. Tra le proteine virali prodotte è particolarmente importante per lo sviluppo di un vaccino la proteina Spike (S), la “falsa chiave” con cui il virus lega il recettore di superficie ACE2 ed infetta le cellule epiteliali, capace di generare la produzione di anticorpi neutralizzanti (cioè in grado di prevenire l’interazione della Spike col recettore ACE2 e quindi impedendo l’infezione). I ricercatori hanno sviluppato un metodo per isolare frammenti selezionati di questo RNA virale, scegliendo solo “le parti” necessarie alla produzione di proteina Spike: in questo modo il nostro corpo produrrebbe (il condizionale è d’obbligo) solo quella, ma non tutte le altre proteine indispensabili al virus per la propria riproduzione.
(11) Oxford University breakthrough on global COVID-19 vaccine
(14) Sanofi’s Two Vaccine Candidates against COVID-19
(15) Live attenuated SARS-CoV-2 vaccine candidate shows protective efficacy in vivo - Clicca qui per la versione PDF
Riferimenti []:
[7] Fan Wu, et al. (2020) A new coronavirus associated with human respiratory disease in China, Nature, 579(7798), p. 265-269 A new coronavirus associated with human respiratory disease in China - Clicca qui per la versione PDF
[9] Logunov, D. Y., et al. (2021) Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia, The Lancet, 397(10275), p. 671-681 - Clicca qui per la versione PDF
[10] Lauer, K. B., Borrow, R., Blanchard, T. J. (2017) Multivalent and Multipathogen Viral Vector Vaccines, 24 (1) - Clicca qui per la versione PDF
[11] Feng-Cai Zhu, et al. (2020) Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial, The Lancet, 396(10249), p. 479-488, - Clicca qui per la versione PDF
[12] Lee, C.S., Bishop, E.S., Zhang, R., et al. (2017) Adenovirus-mediated gene delivery: Potential applications for gene and cell-based therapies in the new era of personalized medicine, Genes & Diseases, 4(2), p. 43-63 - Clicca qui per la versione PDF
[13] Pollet, J., Wen-Hsiang Chen, Strych, U. (2021) Recombinant protein vaccines, a proven approach against coronavirus pandemics, Advanced Drug Delivery Reviews, 170, p. 71-82 - Clicca qui per la versione PDF
[14] Todorov, G., Uversky, V. N. (2020) A Possible Path towards Rapid Development of Live-Attenuated SARS-CoV-2 Vaccines: Plunging into the Natural Pool, 10(10), 1438, Biomolecules
Claudio Messori / e-mail: messori.claudio(at)gmail.com
CLICCA QUI per leggere la TERZA PARTE.
